Apesar de o ferro ser o quarto metal mais abundante na crosta terrestre, os sistemas vivos têm dificuldade em assimilar ferro suficiente para satisfazer suas necessidades. Consequentemente, a anemia por ferropriva é um problema comum nos humanos. Nas plantas, a clorosis, deficiência de ferro que resulta no amarelamento das folhas, também é corriqueira. Os sistemas vivos têm dificuldades em assimilar o ferro porque a maior parte dele nos compostos da natureza tem solubilidade muito baixa em água. Os microorganismos têm se adaptado a esse problema eliminando um composto que se liga ao ferro, chamado sideroforo, que forma um complexo de ferro(III) solúvel em água extremamente estável. Um complexo desse tipo é chamado ferricromo; sua estrutura é mostrada na Figura 1. A força em se ligar ao ferro do sideroforo é tão grande que ele pode extrair ferro de vidraria PyrexTM, solubilizando facilmente o ferro em óxidos de ferro.
A carga total do ferricromo é zero, o que torna possível para o complexo passar pelas paredes bastante hidrofóbicas das células. Quando uma solução diluída de ferricromo é a adicionada a uma suspensão de célula, o ferro é encontrado inteiramente dentro das células em uma hora. Quando o ferricromo entra na célula, o ferro é removido por uma reação catalisada por enzima que reduz o ferro a ferro(II). O ferro em estado de oxidação mais baixo não é fortemente complexado pelo sideroforo. Os microorganismos, dessa forma, adquirem ferro eliminando um sideroforo em seus ambientes imediatos, em seguida obtendo o complexo de ferro resultante para dentro da célula. O processo como um todo está ilustrado na Figura 2.
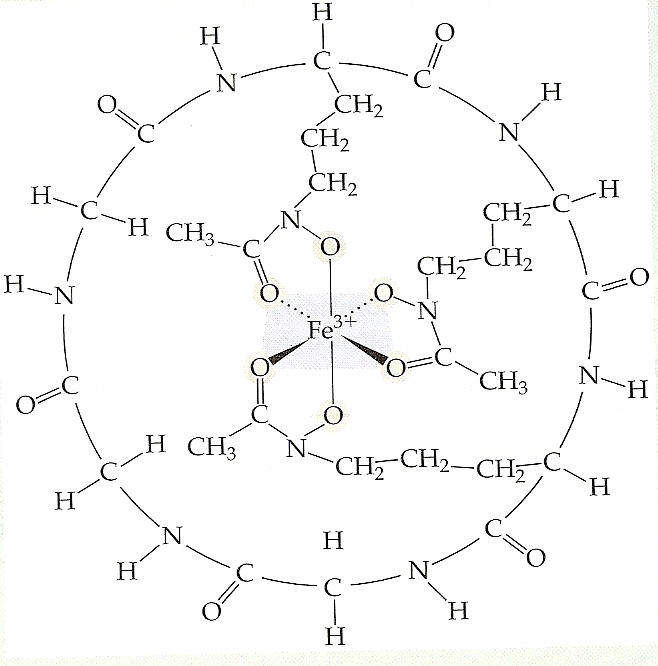
Figura 1 – A estrutura do ferricromo. Nesse complexo um íon Fe+3 está coordenado por seis átomos de oxigênio. O complexo é muito estável; ele tem uma constante de formação de aproximadamente 1030. A carga total do complexo é zero.
Nos humanos, o ferro é assimilado dos alimentos pelo intestino, Uma proteína chamada transferina liga-se ao ferro e o transporta pela parede do intestino para distribuí-lo aos outros tecidos no corpo. Um adulto normal possui um total de 4 g de ferro. Em certo momento, aproximadamente 3 g, ou 75%, desse ferro estará no sangue, principalmente na forma de hemoglobina. A maior parte do restante é transportada pela transferrina. Uma bactéria que infecta o sangue necessita de uma fonte de ferro para crescer e reproduzir. A bactéria elimina um sideroforo na corrente sanguínea para competir com a transferrina pelo ferro que ela mantém. As constantes de formação para se ligarem ao ferro são aproximadamente as mesmas para a transferrina e para a bactéria, mais rapidamente ela pode reproduzir, e, assim, mais dano ela pode causar ao organismo. Vários anos atrás, os clínicos da Nova Zelândia receitavam suplementos de ferro para as crianças logo após o nascimento. Entretanto, incidência de determinadas infecções bacterianas era oito vezes maior em crianças tratadas com suplementos de ferro que nas não tratadas. Presumivelmente, a presença de mais ferro no sangue do que o absolutamente necessário faz com que seja mais fácil para as bactérias obter o ferro necessário para seu crescimento e reprodução.
Nos Estados Unidos é uma prática médica comum suplementar o alimento infantil com ferro uma vez durante o primeiro ano de vida, porque o leite materno é virtualmente destituído de ferro. Dado o que é agora conhecido sobre o metabolismo do ferro pelas bactérias, muitos pesquisadores em nutrição acreditam que a suplementação de ferro em geral não é justificada ou inteligente.
Para as bactérias continuarem a se multiplicar na corrente sanguínea, elas devem sintetizar novos suprimentos de sideroforos. Entretanto, a síntese de sideroforos na bactéria é lenta a medida que a temperatura aumenta para mais de 37 ºC, e pára completamente a 40 ºC. Isso sugere que a febre na presença de um micróbio invasor é um mecanismo usado pelo corpo para destituir a bactéria de ferro.
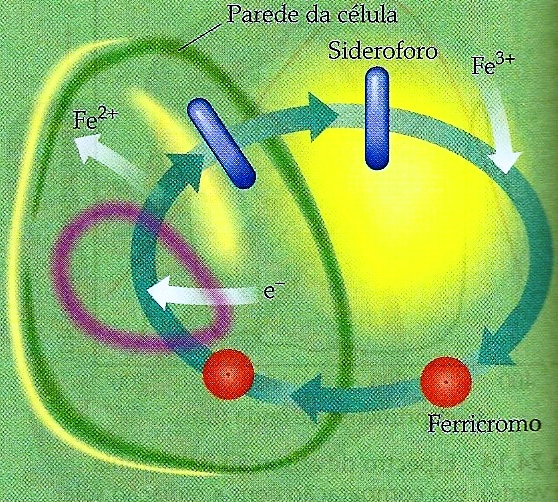
Figura 2 – Sistema que transporta ferro de uma célula de bactéria. O ligante que se une ao ferro, chamado sideroforo, é sintetizado dentro da célula e eliminado no meio vizinho. Ele reage com o íon Fe3+ para formar o sideroforo, que é absorvido pela célula. Dentro da célula o ferricromo é reduzido, formando Fe2+, que não está fortemente ligado pelo sideroforo. Tendo liberado o ferro para uso na célula, o sideroforo pode ser reciclado de volta para dentro do meio.
Extraído de: Química – a ciência central – 9ª edição.
