À partir dos ácidos graxos das gorduras também é possível, à partir de vias sintéticas características, obterem-se álcoois primários. Entre os álcoois primários de cadeia linear que se obtém das gorduras – ou de outros modos – os de C8 e C10 são utilizados na produção de ésteres de alto ponto de ebulição, usados como plastificantes (como por exemplo, o ftalato de octila). Os álcoois de C12 a C18 são utilizados em quantidades enormes na manufatura de detergentes (produtos tensoativos para limpeza).
Embora os detergentes sintéticos difiram significativamente uns dos outros quanto a estrutura química, as moléculas de todos têm uma característica em comum, também apresentada pelas de sabão comum: são anfipáticas, com uma parte apolar muito grande, de natureza de hidrocarboneto, solúvel em óleo, e uma extremidade polar, solúvel em água. Um tipo deles resulta da conversão dos álcoois de C12 a C18 em sais de hidrogenosulfato de alquila. Por exemplo:

Neste sal, a parte apolar é a longa cadeia alquílica e a parte polar é a ponta -SOO3-Na+.
Diferentemente dos sabões, os detergentes podem ser não-iônicos. Pelo tratamento dos álcoois com óxido de etileno, obtém-se um deles:
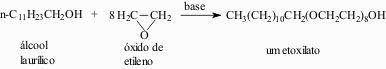
A possibilidade de formação de pontes de hidrogênio entre as moléculas da água e os numerosos átomos de oxigênio do etoxilato tornam a parte terminal de poliéter solúvel em água. Os etoxilatos também podem ser convertidos em sulfatos, sendo utilizados na forma de sais de sódio.
Os sais de sódio dos ácidos alquilbenzeno-sulfônicos são os detergentes mais utilizados. Para obtenção destes detergentes, liga-se primeiramente o grupo alquil de cadeia longa a um anel benzênico pela utilização de um haleto de alquila, de um alceno ou de um álcool conjuntamente com um catalisador de Friedel-Crafts (AlCl3); em seguida, efetua-se a sulfonação e, finalmente, a neutralização:
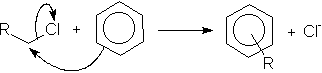
reação de alquilação por adição nucleofílica aromática em haleto de alquila
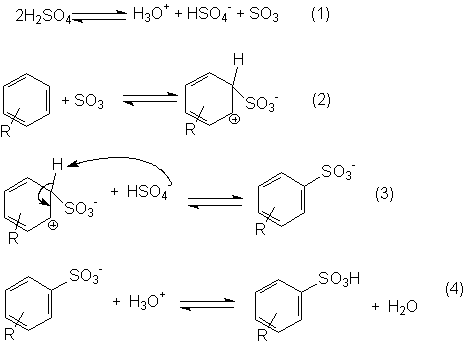
Mecanismo da reação de sulfonação
O primeiro passo, em que se forma o trióxido de enxofre (SO3), eletrofílico, é simplesmente um equilíbrio ácido-base entre duas moléculas de ácido sulfúrico. Na sulfonação utiliza-se geralmente o ácido sulfúrico fumegante, ou seja, aquele onde é dissolvido excesso de SO3; mesmo quando utiliza-se apenas ácido sulfúrico, crê-se que o SO3 formado no passo (1) possa ser o eletrófilo.
No passo (2) o reagente eletrofílico, SO3, liga-se ao anel benzênico com formação de um carbocátion intermediário. Embora o trióxido de enxofre não tenha cargas positivas, tem deficiência de elétrons (carga parcial positiva) sobre o átomo de enxofre, pois os três átomos de oxigênio, mais eletronegativos, retiram-lhe elétrons por indução.
Na terceira etapa o carbocátion cede um próton para o ânion HSO4- e forma o produto de substituição estabilizado por ressonância que é, desta vez, um ânion – o do ácido benzeno-sulfônico; este ácido, por ser forte, encontra-se altamente ionizado (na etapa 4, o equilíbrio está muito deslocado para a esquerda).
Com alguns substratos aromáticos e certos acidulantes, o eletrófilo pode ser HSO3+ ou moléculas que possam facilmente transferir SO3 ou HSO3+ para o anel aromático.
A conclusão da síntese do detergente dá-se pela neutralização do ácido benzenosulfônico, formando o sal hidrosolúvel.
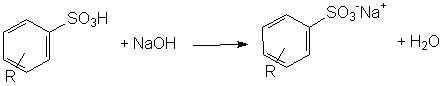
Neutralização do ácido benzenosulfônico.
Até há algum tempo atrás, utilizava-se vulgarmente o propileno para a síntese destes alquilbenzeno-sulfonatos. A cadeia lateral altamente ramificada impedia a degradação biológica do detergente. Na maioria dos países industrializados, estes detergentes vêm sendo substituídos por outros biodegradáveis desde 1965. São sulfatos de alquila, etoxilatos e respectivos sulfatos, e alquilbenzenosulfonatos em que o grupo fenila fixa-se ao acaso a qualquer das diversas posições secundárias da longa cadeia alifática linear (C12-C18). As cadeias laterais destes alquilbenzeno-sulfonatos lineares obtém-se de 1-alcenos de cadeia linear ou de alcanos de cadeia contínua clorados, separados do ceroseno por formação de clatratos (peneiras moleculares).
Estes detergentes atuam essencialmente da mesma maneira que o sabão. A sua utilização oferece, entretanto, certas vantagens. Por exemplo, os sulfatos e sulfonatos mantém-se eficazes em água dura devido ao fato de os correspondentes sais de cálcio e magnésio serem solúveis. Visto serem sais de ácidos fortes, produzem soluções neutras, ao contrário dos sabões que, por serem sais de ácidos fracos, originam soluções levemente alcalinas.
Comentários
