Aplicação
O cálculo do calor de reação é regido pela aplicação da Lei de Hess (lei da soma dos calores de reação), cujo enunciado é o seguinte:
“A variação de entalpia, ou seja, quantidade de calor liberada ou absorvida por um processo só depende do estado inicial e final do processo, não dependendo das etapas intermediárias.”
Vejamos a aplicação dessa lei na reação de combustão do carbono grafite fornecendo gás carbônico.
A obtenção de CO2(g) se realizará não importando o número de etapas em que a reação se processe. CO2(g) pode ser escrita através de dois processos.
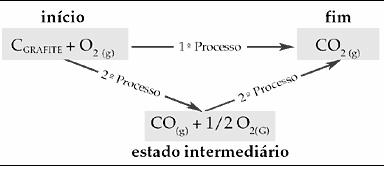
Importância:
1) Permitiu que as equações termoquímicas fossem realizadas a céu aberto.
2) Permitiu calcular a entalpia de várias substâncias até então desconhecidas, a partir do H da própria reação.
3) Permitiu calcular a entalpia de várias reações difíceis de ocorrer pelo método direto, ou seja, reações que ocorrem pelo método indireto.
Conseqüências da Lei de Hess
– As equações termoquímicas pode ser somadas como se fossem equações matemáticas ou algébricas.
– Invertendo-se uma equação termoquímica o sinal do ![]() H também será invertido
H também será invertido
– Multiplicando-se ou dividindo-se uma equação termoquímica por um número diferente de zero o valor do ![]() H também será multiplicado ou dividido por esse número.
H também será multiplicado ou dividido por esse número.
