OXIDAÇÃO: É a perda de elétrons, o NOX aumenta;
REDUÇÃO: É o ganho de elétrons, o NOX diminui;
AGENTE OXIDANTE: É a espécie química que ganhou elétrons na reação química (sofreu redução e provocou oxidação em outra espécie química).
AGENTE REDUTOR: É a espécie química que perdeu elétrons na reação química (sofreu oxidação e provocou redução em outra espécie química)
|
Redução: ganho de elétrons ( diminuição de Nox) |
|
Oxidação: perda de elétrons ( aumento de Nox) |
|
Redutor: fornece elétrons e se oxida (Nox aumenta) |
|
Oxidante: recebe elétrons e se reduz (Nox diminui) |
|
O redutor reduz o oxidante |
|
O oxidante oxida o redutor |
Balanceamento por oxi-redução
Coeficiente na reação:
2KMnO4 + 5H2C2O4 + H2SO4 → K2SO4 + MnSO4 + CO2 + H2O
Prosseguir por tentativa:
2KMnO4 + 5H2C2O4 + 3H2SO4 → 1K2SO4 + 2MnSO4 + 10CO2 + 8H2O
A quantidade de oxigênio é o tira prova.
Obs. 1: Sofreu redução o elemento quimico manganês.
Obs. 2: Quem sofreu oxidação foi o elemento quimico carbono.
Obs. 3: O agente oxidante foi a espécie quimica KMnO4.
Obs. 4: O agente redutor foi a espécie química H2C2O4.
Casos particulares de balanceamento por oxi-redução.
1) A substância ou o elemento que sofre auto oxi-redução não vai para o quadro.
2) A substância ou o elemento que sofre auto oxi-redução pode funcionar tanto como oxidante quanto como redutor, desde que esteja no lado dos reagentes.
Aplicação
Faça o balanceamento da reação abaixo:
Cl2+ NaOH → NaCl+NaClO2+H2O
Solução:
1.º passo: Calcular o Nox de cada elemento.
2.º passo: Traçar o ramal da oxidação e da redução e calcular a quantidade de elétrons perdidos e recebidos.
3.º passo: Montar os quadros.
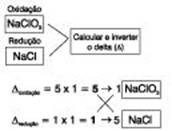
Prosseguir o balanceamento por tentativa:
3Cl2 + 6NaOH → 5NaCl + 1NaClO3 + 3H2O
Esta é uma reação de outo oxi-redução, pois possui o mesmo elemento (Cl) que se oxida e reduz ao mesmo tempo.
Observações:
1) A quantidade de oxigênio antes depois da reação, tem de ser a mesma.
2) Sofreu redução o elemento químico Cloro.
3) Sofreu oxidação o elemento químico Cloro.
4) O agente oxidante e agente redutor é a mesma espécie quimica Cl2.
