A manufatura do sabão constitui uma das sínteses químicas mais antigas; menos antiga, entretanto, que a produção do álcool etílico utilizado nas bebidas – os anseios de limpeza do homem são, na verdade, muito mais recentes que seus desejos de estímulo alcoólico. Ao ferverem o sebo de cabra com a lexívia potássica feita com as cinzas de madeira, as tribos germânicas, contemporâneas de César, realizaram a mesma reação química que o processo moderno de fabricação de sabão: a hidrólise de glicerídios. A reação dá origem aos sais de ácidos carboxílicos e ao glicerol:
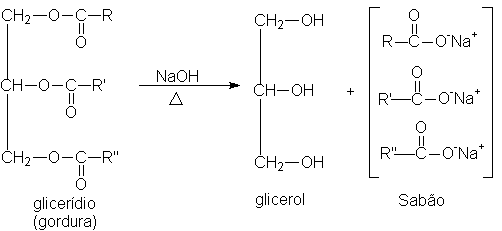
O sabão comum que utilizamos atualmente é simplesmente uma mistura de sais de sódio ou potássio de ácidos graxos de cadeia longa. É uma mistura porque a gordura a partir da qual é preparado é constituída de uma mistura de ácidos graxos, mas que é tão eficiente para lavagem quanto um sal puro.
As características do sabão podem variar de acordo com a composição e segundo o método de fabricação: se preparado a partir do azeite de oliva, recebe o nome de sabão de Marselha; pode-se adicionar álcool durante o processo de fabricação para torná-lo transparente; por agitação, pode-se incorporar ar, fornecendo-lhe a propriedade de flutuar; podem-se adicionar perfumes, corantes e germicidas; se for utilizado o hidróxido de potássio na síntese (ao invés do de sódio), tem-se o sabão mole. Entretanto, quimicamente o sabão permanece exatamente o mesmo, atuando do mesmo modo.
À primeira vista, pode-se ter a impressão de que estes sais são solúveis em água; de fato, podem-se preparar as chamadas “soluções da sabão”. Elas não são, entretanto, verdadeiras soluções, onde as moléculas do soluto movem-se livremente entre as moléculas do solvente. Verifica-se, na realidade, que o sabão se dispersa em agregados esféricos denominados micelas, cada uma das quais pode conter centenas de moléculas de sabão.
Uma molécula de sabão tem uma extremidade polar, -COO-Na+, e uma parte não polar, constituída por uma longa cadeia alquílica, normalmente com 12 a 18 carbonos. A extremidade polar é solúvel em água (hidrófila – que tem afinidade por água). A parte apolar é insolúvel em água, e denomina-se hidrófoba (ou lipófila – que tem aversão por água e afinidade por óleos e gorduras), mas é evidentemente solúvel em solventes apolares. Moléculas que têm extremidades polares e apolares e, além disso, são suficientemente grandes para que cada extremidade apresente um comportamento próprio relativo à solubilidade em diversos solventes denominam-se anfipáticas.
De acordo com a regra “polar dissolve polar; apolar dissolve apolar”, cada extremidade apolar procura um ambiente apolar. Em meio aquoso, o único ambiente deste tipo existente são as partes apolares das outras moléculas do sabão, e assim elas se agregam umas às outras no interior da micela. As extremidades polares projetam-se da periferia dos agregados para o interior do solvente polar, a água. Os grupos carboxilatos carregados negativamente alinham-se à superfície das micelas, rodeados por uma atmosfera iônica constituída pelos cátions do sal. As micelas mantém-se dispersas devido à repulsão entre as cargas de mesmo sinal das respectivas superfícies.
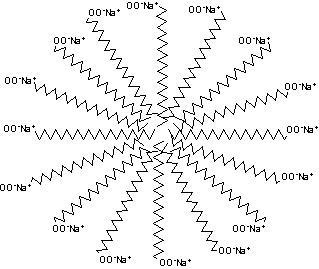
Uma micela pode conter centenas de moléculas de sais de ácidos graxos
Ainda resta, entretanto, uma questão cabal a responder: como o sabão remove a gordura, sendo feito dela? O problema na lavagem pelo sabão está na gordura e óleo que constitui ou que existe na sujeira. Apenas a água não é capaz de de dissolver as gorduras, por serem hidrofóbicas; as gotas de óleo, por exemplo, em contato com a água, tendem a coalescer (aglutinar-se umas às outras), formando uma camada aquosa e outra oleosa. A presença do sabão, entretanto, altera este sistema. As partes apolares das moléculas do sabão dissolvem-se nas gotículas do óleo, ficando as extremidades de carboxilatos imersas na fase aquosa circundante. A repulsão entre as cargas do mesmo sinal impede as gotículas de óleo de coalescerem. Forma-se, então, uma emulsão estável de óleo em água que é facilmente removida da superfície que se pretende limpar (por agitação, ação mecânica, etc.). Deste modo, sabões atuam, no processo de limpeza, como surfactantes – compostos com ação ativa em superfícies ou interfaces de substâncias.
A chamada água dura contém sais de cálcio e magnésio que reagem com o sabão formando carboxilatos de cálcio e magnésio insolúveis. Você nota que a água de uma determinada região é dura quando forma-se uma crosta nas bordas do recipiente que continha o sabão ou quando, ao tomar banho ou lavar as mãos, sente que uma fina película permanece sobre sua pele. Águas subterrâneas são, via de regra, ricas em cálcio e magnésio e, portanto, duras.
Comentários
