Classificação das substâncias
Simples: constituída por um único elemento químico.
Exs.: O2, H2, N2, P4, Fe, C.
Atomicidade – quantidade de átomos na molécula. Ex.: O2 apresenta atomicidade 2.
Composta: constituída por mais de um elemento químico.
Exs.: CO2, H2O, CH4, C2H5OH, Fe2O3.
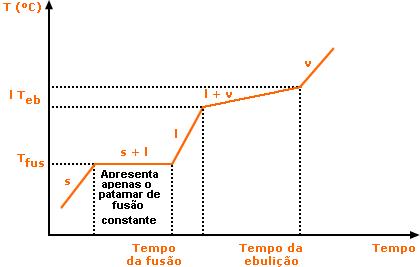
As substâncias apresentam propriedades físicas bem definidas, ou seja apresenta ponto de fusão e ebulição constantes.
Gráfico de uma substância Pura (Apresenta 2 patamares constantes: o de fusão e ebulição)
.jpg)
Mistura
É qualquer sistema formado de duas ou mais substâncias puras, denominadas componentes. Não apresentam ‘constantes físicas’ definidas; ponto de fusão, ebulição, densidade absoluta, mudam com a composição da mistura.
Classificação de Misturas:
Homogêneas (Soluções) Constitui uma só fase
Exs.: Água + Álcool, Ar atmosférico (Lembre-se que os gases sempre se misturam homogeneamente)
Heterogêneas Constitui duas ou mais fases
Exs.: Água + Areia, Água + Óleo + Areia
Fase
É cada uma das partes homogêneas de um sistema. Cada fase é caracterizada por uma densidade diferente.
Componente
É cada substância que entra na composição do sistema.
MISTURAS AZEOTRÓPICAS E EUTÉTICAS
Mistura Azeotrópica:
A temperatura mantém-se constante durante a ebulição, e a composição não muda. Ex.: 96% de álcool etílico com 4% de água (álcool 96 °GL)
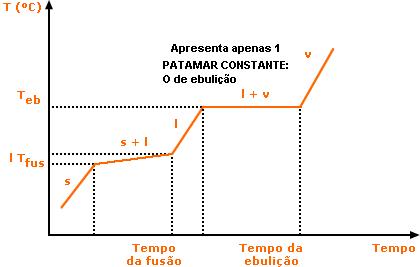
Mistura Eutética:
É o tipo de mistura que funde à temperatura constante, mas apresenta uma faixa de ebulição. Um exemplo importante deste tipo de mistura é a solda 63% Sn e 37% Pb.